注意了!药品上市后变更管理沟通仅限1名注册专员和1次交流机会
属于国家管控危险化学品,根据相关法规和网安部门规定,本网站不提供该产品相关销售信息。
2021年12月31日(最后一个工作日),千呼万唤始出来,西藏自治区药品监督管理局官网终于正式对外发布了《西藏自治区药品上市后变更管理沟通交流工作程序和要求》,自2022年1月1日起施行,正式能出现在全国31个省局已发布的涉及上市后变更配套政策发布名单上了,笔者梳理了《西藏自治区药品上市后变更管理沟通交流工作程序和要求》亮点内容,有些干货内容如上市后变更沟通仅限1名注册专员和1次交流机会,需要MAH引起重视的,根据笔者变更工作中积累的一些浅显经验,梳理了上市后变更沟通过程中必须要格外注意的问题,以期为同类问题的解决提供参考和帮助,提高与省局沟通效率。
国家药监局制定了首部专门针对药品上市后变更管理的规范性文件-《药品上市后变更管理办法(试行)》,自2021年1月13日起发布实施,宣告新监管时代的药品上市后变更管理体系的到来,对省局的上市后变更管理提出了较高的要求,其中第21条明确境内持有人在充分研究、评估和必要的验证基础上无法确定变更管理类别的,可以与省级药品监管部门做沟通,具体沟通程序由各省级药品监督管理部门自行制定;第22条明确降低技术指导原则中明确的变更管理类别,或降低持有人变更清单中的变更管理类别,境内持有人应当在充分研究、评估和必要验证的基础上与省级药品监管部门沟通。
1)沟通交流人员要求:持有人应指定并授权1名药品注册专员作为沟通交流人员。该药品注册专员应是熟悉药品注册法规的专业技术人员,负责递交资料、会议沟通接洽、邀请企业参会人员、补充资料等。自治区药监局仅与药品注册专员做沟通接洽。如果药品注册专员发生变更,持有人应另行授权并及时告知。
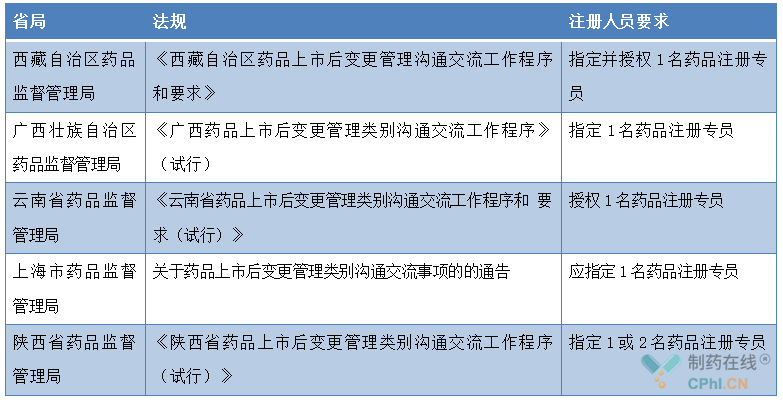
笔者检索了对注册专员人员有限制的省份,目前有西藏、广西、云南、上海市省局有要求指定1名药品注册专员,陕西省指定1或2名药品注册专员,具体要求如下表:
1)沟通交流次数:仅组织1次沟通交流,即同一药品的同一变更事项,原则上不可以重复提交沟通交流申请。
1)受理沟通交流申请时限要求:自收到相关材料后15个工作日内完成初审。不符合相关规定情形的,书面回复持有人终止沟通交流;
2)补正时限要求:存在资料不全的,书面通知持有人在7日内补全资料;符合标准要求的,依照本程序进入沟通交流环节。
3)沟通交流答复期限要求:药品注册处应在沟通交流结束后的20个工作日内书面答复。
1)无法确定变更管理类别,即法律、法规、规章或技术指导原则中未明确变更管理类别,且持有人在充分研究、评估和必要的验证基础上仍无法确定管理类别;
原料药已获登记号状态是指“与制剂共同审评审批结果”,有两种状态,分别是“A”和“I”代表含义分别是:
药品批准证明性文件:包括申报药品历次获得的批准文件,如药品注册证书、药品补充申请批件、药品再注册批件等。相应文件应当能够清晰说明该品种完整的变更过程。
①基于药品特点,描述药品基本情况。②变更的原因、详细情况、说明变更的必要性和合理性。
我们能够准确的看出,随着中国药品监管改革,国家和各地方药监局服务意识显著地增强,不断开辟与MAH沟通交流新渠道,如上市后变更管理中复杂问题沟通交流的渠道,西藏自治区药品监督管理局积极学习国家局有关政策法规,向优秀省局学习,制定并发布了符合当地发展需求的沟通管理政策,藏药迄今已有上千年的历史,是我国较为完整、较有影响的民族药之一,西藏是藏医药的发源地,常用藏药有360多种,《西藏自治区
管理沟通交流工作程序和要求》明确已上市藏药的变更尊重藏药特点和发展规律,可遵循藏医药理论、人用经验和临床试验相结合的证据体系要求,值得其他省局学习,通过变更沟通交流,不仅有利于MAH提高变更效率,也能够大大减少监管部门做低水平的重复工作,而把有限的审评资源用于更重要的技术审评上,从这个意义而言,变更沟通交流是双方共赢的事情。
更多
一周药闻复盘CPHI制药在线到联合CAR-T,mRNA技术寻找再崛...
本周,大热点没有,小热点不少。审评审批方面,国内来说,几个...[详细]
从PD-1联合mRNA,到CAR-T联合mRNA疫苗治疗,在进军肿瘤领域的路上,...[详细]
鉴于国内利尿市场巨大的潜力以及布美他尼本身过硬的质量,这6...[详细]
回顾自己十多年职业生涯,发现所待过的企业都没有特定的质量...[详细]
质量控制实验室GMP指南(2023版)1300问(第8章)电子版...
什么是分析方法?什么是分析方法验证?什么是分析方法确认?什...[详细]


