/地区药品监督管理的机构批准的第一个可在其管辖区域内上市销售的某原研药的仿制产品,如2018
模仿性,首仿药本质是仿制药(generics),并非原创性的创新。通常是分析原研药的文献、专利中透露的信息,结合反向工程分析产品,从而模仿制造。时序性,必须是某原研药的首个获批上市的仿制药,而非提交仿制药上市申请的次序。区域性,不同国家/地区有不同的药物监管政策、专利法律、及其他行政条款,仿制药不太可能多地同时首个获批上市,因此通常没有“国际首仿”,而是中国首仿、美国首仿等。
首仿药的三个特点中最重要的是时序性,这是其区别于其他仿制药的根本,也是其名称中“首”字的来源。那么怎么样才可以首个获批上市呢?主要有两种方式:正常路子和野路子。
正常路子就是等原研药专利到期,再上市销售首仿药。早期只能在专利到期才能开展商业研究,提交上市申请,但这样无形中延长了原研药的专利保护期。后来FDA引入Bolar例外,在原研药专利到期前可开展非商业化的研究。FDA的最新政策为在专利到期前可提交仿制药的简略新药申请(ANDA),并可获得暂时批准(tentative approval),待原研药专利到期后,仿制药企再向FDA提出申请,转为正式批准。
如果像Meters/bonwe(美特斯邦威)那样不走寻常路的话,那就走“野路子”。蹊径开辟的好,效果完爆正常路子。不等原研药专利到期,仿制药企就发动“专利挑战”(patent challenge),即指出原研药专利(某个或几个)无效的证据,通过诉讼并胜诉(也可能无诉讼)之后,再通过药监部门的审批,即可上市销售首仿药。当然某些特殊情况能够最终靠技术革新规避原研药专利的权利要求,从而比较顺畅地获批上市。
由上可见,不论首仿药采取何种途径上市,都绕不开专利,要么被动等待,要么主动挑战/规避。下面我们以美国FDA为代表,谈谈与首仿药联系最为紧密的药品专利链接制度。为何不谈欧盟、日本呢?这是因为它们没有药品专利链接制度。美、欧、日虽然同为成熟医药市场,但发展历史不同,药品专利政策各异。美国作为统一的大市场,创新药与仿制药的协调发展做地最好,专利政策相对活跃宽松。欧盟市场既统一又分散,政策协调统一费时费力,专利政策不够灵敏而导致仿制药不够活跃。日本药企发展由仿及创,与欧美药企合作密切,且发达医保导致对价格不敏感,对仿制药的重视一度不足。
药品专利链接制度(pharmaceutical patent linkage system)是指仿制药上市批准与参照药的专利相关联,即仿制药注册申请应当考虑先前上市的参照药(原研药)的专利状况,从而避免可能的专利侵权。
虽然现在FDA的各种法规被奉为圭臬,被他国药监部门争相效仿,从但美国的药品专利链接制度也不是一蹴而就的,而是经历了几十年的发展和演变。1962年,美国的《科夫沃-哈里斯法案》(Kefauver-Harris Act)生效后,FDA要求包括仿制药在内的所有药品上市前都有必要进行验证安全性和有效性的临床试验,这导致仿制药的开发成本过高;还要仿制药在原研药专利过期后才能提交临床申请,这延迟了仿制药的上市时间。1962年的法案导致仿制药开发成本高且上市慢,二十多年间仿制药获批数量屈指可数,高企的药品价格引发药企与公众的矛盾。
有鉴于此,美国国会于1984年通过了《药物价格竞争和专利期恢复法案》(Drug Price Competition and Patent Term Restoration Act)。因该法案由国会议员Orrin Hatch和Henry Waxman联合提议,又称为Hatch-Waxman法案。该法案及后续补充修订深刻地改变了美国的制药行业,使仿制药处方占有率从1984年的不足20%,达到2017年的89%(OECD Health Statics 2017),有效地控制了美国人均药品消费。H-W法案的发布可以称为美国仿制药发展历史中具有划时代意义的重大事件,有必要对其分析一下。H-W法案中具有与本文主题有关,且影响较大的有以下5项制度。
美国的新专利有效期通常为自提交专利申请起20年。H-W法案授权美国专利及商标局(USPTO)延长新药的专利保护时间,以弥补专利权人因FDA对药物审评审批所占用的专利时间。具体操作为FDA占用的时间占1天补1天,专利权人回复官方审查、临床试验、准备文件等占用的时间,用1天补半天,总体不超过5年。专利延长期加剩余专利期(NDA获批后专利期剩余时间)综合不超过14年。
专利补偿时间 = 1/2*(临床试验申请到新药上市申请的时间) +新药上市申请审查时间
橙皮书正式名称为《经治疗等效性评价的批准药品》(Approved Drug Products with Therapeutic Equivalence Evaluation),因此前发布的纸质书封面为橙色,俗称橙皮书。FDA要求申请人提交新药上市申请(NDA)的同时以FDA 3542a表格提交专利信息,FDA将有关专利登记在橙皮书(Orange Book)上并公示。NDA获批后仍可以提交专利信息,但须使用FDA 3542表格。须注意FDA只负责登记,每月更新一次,不对专利内容和/或法律负责。专利登记制度使仿制药规避或挑战专利都有了明确的标的。
要求登记的专利包括:活性成分(化合物)专利,制剂/配方专利,方法/用途专利,活性成分的不同晶型。可以不登记的专利包括:制备方法,中间体,盐,酯,水合物,溶剂化物,异构体,结晶体等。
仿制药在提交上ANDA时,须对相应参照药在橙皮书中所列的专利做出专利状态声明,分为以下4类。
Paragraph III: 有专利,但是本申请不寻求在专利有效期内上市
提交I、II类声明,即为无专利争议。提交III类声明,FDA可授予“暂时批准(tentative approval)”,在参照药的专利到期后即可上市。提交IV类声明,即视为“专利挑战”。

在H-W法案发布之前,美国的药物法规不涉及专利事宜,FDA和USPTO(美国专利及商标局)各司其职。FDA专事于药物的安全性和有效性管理,专利的授权和争议归属于USPTO和法院。H-W法案规定仿制药上市或专利争议依据以橙皮书登记专利为准,通过仿制药的上市申请审批与原研药的专利有效性审核的链接,以及FDA和USPTO职能上的衔接,有助于在仿制药审批结束前解决专利权属纠纷问题,降低药品上市后的诉讼可能。专利链接公开透明,有利于各方评估研发风险,使药品更加经济合理。
以下流程图显示药品专利链接制度涉及多个部门机构,是一个相互嵌套、多方合作与交流的机制。FDA是药品专利链接制度的主要监管部门,负责橙皮书的修订、公示以及药品的注册审评工作。USPTO协助FDA审查其中的专利申明的有效性,作为FDA批准仿制药上市的依据之一。法院负责审理仿制药申请人与原研药专利权人的专利纠纷,同时通知FDA开启对仿制药30个月的遏制期。下文我们再对各步骤展开阐述。
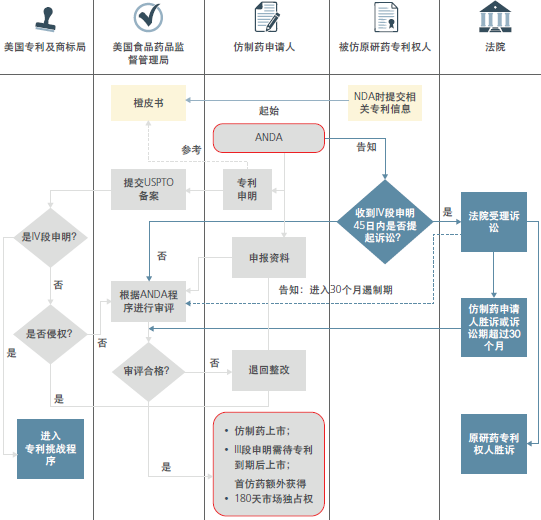
H-W法案授权FDA给予新药试验数据独占,指药品获批上市后,在一段时间内,药监部门不受理利用该药品安全性和有效性数据的仿制药上市申请。数据独占时间长短因药物类型而异。并不加成到专利期上。
自新药上市申请(NDA)获批时开始计时。禁止FDA接受审查具有相同活性成分的仿制药上市申请(ANDA)或改良型新药上市申请(505b(2) NDA)。如上市申请不带有对橙皮书中登记专利的PIV声明,则数据独占为5年,反之则为4年。
自新药上市申请(NDA)获批时开始计时。因为不是新化学实体,此处应属于改良型新药,所以也有人把此类称为“新剂型/新用途数据独占”。当申请或者补充含有申请人执行或主办的,并且对获批关键的新临床研究(非生物利用度研究),则授予该药3年数据独占。禁止FDA批准任何基于原研药企为支持药品批准或药品变更而提交的资料的ANDA或505(b)(2)申请。
对首个提交仿制药上市申请(ANDA)及PIV证明,经过一系列流程(后文详述),最终被FDA批准上市的仿制药给予180天的市场独占作为奖励。自申请者开始商业销售仿制药产品之日开始,或从法院判决专利无效、不可执行或不侵权之日开始,以两者中较早者为准。FDA并不给申请者发信提示授予独占,而橙皮书是发布此类消息的官方载体。
在现有专利/独占期的基础上延长。作为对FDA书面要求的回应,如果发起人执行并提交关于药品活性成分的儿科研究,则在其专利期和/或独占期结束后可获得额外6个月的市场保护。儿科独占可与5年、3年或孤儿药独占叠加。有关规定法律为《儿童最佳药物法案》(Best Pharmaceuticals for Children Act)和1997年《FDA现代化法案》(FDA Modernization Act )第505(A)部分。
专利权由专利和商标局在开发阶段授予,囊括广泛的权利要求。排他性的独占是FDA在药物批准之时授予的,与专利同时或不同时运行。独占在挑战专利中起着很重要的作用,因为它不受橙皮书专利的影响。有些原研药会衡量专利权与独占之间的关系,有时会主动放弃专利权,保留独占,使得仿制药无法通过挑战专利提前上市。由于FDA对儿童用药的特殊规定,原研药往往在专利到期之前申请儿童用药实验,以此达到延长专利的目的。仿制药在挑战专利时,须认真考虑独占和专利期的关系。
此外必须要格外注意,虽然美国生物药有12年的独占,但美国的生物类似药不适用专利链接制度。因生物类似药很复杂,和化学仿制药差距较大,有其他的现在仍在持续不断的发展的有关政策来约束管理,在此就不赘述了。
(4)介绍美国H-W法案与首仿药相关5大制度:专利期补偿制度、橙皮书专利登记制度、仿制药简化申请与专利状态声明制度、FDA与USPTO的链接制度、药物试验数据独占制度。
在下篇,我们将讨首仿药专利挑战的基本流程,H-W法案之后专利挑战有关政策的发展,以及在美国市场开发首仿药的机会简析。返回搜狐,查看更加多
下一篇:两个国产首仿药要上市了


